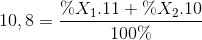Mẹo về Trong một nguyên tử biểu thức nào sau này không đúng Chi Tiết
Pro đang tìm kiếm từ khóa Trong một nguyên tử biểu thức nào sau này không đúng được Update vào lúc : 2022-03-18 08:35:12 . Với phương châm chia sẻ Bí quyết Hướng dẫn trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi tìm hiểu thêm nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Mình lý giải và hướng dẫn lại nha.
Số khối hay số hạt, (ký hiệu A, từ tiếng Đức Atomgewicht nghĩa là khối lượng nguyên tử),[1] còn được gọi là số nucleon, là tổng số proton và neutron (gọi chung là nucleon) trong một hạt nhân nguyên tử. Nó gần bằng khối lượng nguyên tử (còn gọi là đồng vị) của nguyên tử được biểu thị bằng cty khối lượng nguyên tử. Vì proton và neutron đều là baryon nên số khối A giống với số baryon B của hạt nhân (và của toàn bộ nguyên tử hoặc ion). Số khối là rất khác nhau riêng với mỗi đồng vị rất khác nhau của một nguyên tố hóa học. Do đó, hiệu giữa số khối và số nguyên tử Z là số nơtron (N) trong một hạt nhân nhất định: N = A − Z, hay A = Z + N[2]
Số khối được viết sau tên nguyên tố hoặc dưới dạng ký tự trên bên trái ký hiệu của nguyên tố. Ví dụ, đồng vị phổ cập nhất của cacbon là cacbon-12, hoặc 12C, có 6 proton và 6 neutron. Ký hiệu đồng vị khá đầy đủ cũng tiếp tục có số nguyên tử (Z) dưới dạng chỉ số con ở bên trái của ký hiệu nguyên tố ngay phía dưới số khối:
6
12
C
displaystyle _6^12mathrm C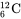
Các loại phân rã phóng xạ rất khác nhau được đặc trưng bởi sự thay đổi của chúng về số khối cũng như số nguyên tử, theo định luật dịch chuyển phóng xạ của Fajans và Soddy. Ví dụ, uranium-238 thường bị phân rã bởi phân rã alpha, trong số đó hạt nhân mất đi hai neutron và hai proton dưới dạng một hạt alpha. Như vậy số hiệu nguyên tử và số nơtron mỗi loại giảm sút 2 (Z : 92 → 90, N : 146 → 144), do đó số khối giảm 4 (A = 238 → 234); kết quả là một nguyên tử thori-234 và một hạt alpha (
2
4
H
e
displaystyle _2^4mathrm He
):[4]
238
92U
→
234
90Th
+
4
2He2+
Mặt khác, carbon-14 bị phân rã với phân rã beta, Từ đó một nơtron được biến hóa thành một proton với việc phát xạ của một điện tử và một phản neutrino. Như vậy số hiệu nguyên tử tăng 1 (Z : 6 → 7) và không thay đổi số khối (A = 14), còn số nơtron giảm 1 (N : 8 → 7).[5] Nguyên tử tạo thành là nitơ-14, với bảy proton và bảy neutron:
14
6C
→
14
7N
+
e⁻
+
ν
e
Sự phân rã beta hoàn toàn có thể xẩy ra chính bới những isobar[6] có sự khác lạ về khối lượng theo thứ tự của một vài khối lượng điện tử. Nếu hoàn toàn có thể, một nuclide sẽ trải qua quy trình phân rã beta thành một isobar liền kề có khối lượng thấp hơn. Trong trường hợp không còn những chính sách phân rã khác, một dòng phân rã beta kết thúc tại isobar có khối lượng nguyên tử thấp nhất.
Một dạng phân rã phóng xạ khác mà không thay đổi số khối là phát xạ tia gamma từ đồng phân hạt nhân hoặc trạng thái kích thích siêu bền của hạt nhân nguyên tử. Vì toàn bộ những proton và nơtron không thay đổi trong hạt nhân trong quy trình này, nên số khối cũng không đổi.
Số khối được cho phép ước tính khối lượng đồng vị đo bằng cty khối lượng nguyên tử (u). Đối với 12C, khối lượng đồng vị đúng là 12, vì cty khối lượng nguyên tử được xác lập là một trong/12 khối lượng của 12C. Đối với những đồng vị khác, khối lượng của đồng vị thường nằm trong mức chừng 0,1 u so với số khối. Ví dụ, 35Cl (17 proton và 18 nơtron) có số khối là 35 và khối lượng đồng vị là 34,96885. Sự khác lạ của khối lượng đồng vị thực tiễn trừ đi số khối của một nguyên tử được gọi là khối lượng dư,[7] riêng với 35Cl là –0,03115. Không nên nhầm lẫn thừa khối lượng với sai biệt khối lượng, vốn là yếu tố khác lạ giữa khối lượng của nguyên tử và những hạt cấu thành của nó (rõ ràng là proton, neutron và electron).
Có hai nguyên do cho việc dư thừa khối lượng:
Không nên nhầm lẫn số khối với khối lượng nguyên tử tiêu chuẩn (còn gọi là khối lượng nguyên tử) của một nguyên tố, là tỷ số giữa khối lượng nguyên tử trung bình của những đồng vị rất khác nhau của nguyên tố đó (khối lượng theo khối lượng riêng) với cty khối lượng nguyên tử thống nhất.[8] Khối lượng nguyên tử là một khối lượng thực tiễn (sẽ là tương đối, tức là một tỷ suất), trong lúc số khối là một số trong những đếm (và do đó là một số trong những nguyên).
Giá trị trung bình có trọng số này hoàn toàn có thể khá khác với những giá trị gần nguyên cho những khối lượng đồng vị riêng lẻ. Ví dụ, có hai đồng vị chính của clo: clo-35 và clo-37. Trong bất kỳ mẫu clo nhất định nào chưa bị phân tách khối lượng sẽ có được tầm khoảng chừng 75% nguyên tử clo là clo-35 và chỉ 25% nguyên tử clo là clo-37. Điều này được cho phép clo có khối lượng nguyên tử tương đối là 35,5 (thực tiễn là 35,4527g/mol).
Hơn nữa, khối lượng trung bình có trọng số hoàn toàn có thể gần số nguyên, nhưng đồng thời không tương ứng với khối lượng của bất kỳ đồng vị tự nhiên nào. Ví dụ, brom chỉ có hai đồng vị bền, 79Br và 81Br, với hiện hữu tự nhiên với những tỷ suất gần bằng nhau, dẫn đến khối lượng nguyên tử tiêu chuẩn của brom gần bằng 80 (79,904 g/mol),[9] tuy nhiên đồng vị 80Br với khối lượng như vậy là không bền.
Bài viết này vẫn còn đấy sơ khai. Bạn hoàn toàn có thể giúp Wikipedia mở rộng nội dung để bài được hoàn hảo nhất hơn.
- x
- t
- s
Đề bài
Câu 1: Cho 2 nguyên tố X (Z=12) và Y (Z=15). Nhận định nào sau này là đúng
A. Tính sắt kẽm kim loại của X>Y
B. Tính sắt kẽm kim loại của Y>X
C. Tính phi kim của X>Y
D. Tính phi kim của X=Y
Câu 2: Trong những câu sau này, câu nào không đúng ?
A. Trong nguyên tử, số electron ở phần vỏ bằng số proton của hạt nhân.
B. Hạt nhân có kích thước rất nhỏ bé so với nguyên tử.
C. Số khối A = Z + N.
D. Nguyên tử khối bằng số nơtron trong hạt nhân.
Câu 3: Cho 3 nguyên tử (_12^24Mg); (_12^25Mg); (_12^26Mg). Phát biểu nào sau này sai?
A. Đây là 3 đồng vị
B. Ba nguyên tử trên thuộc nguyên tố Mg
C. Số proton mỗi nguyên tử đều là 12
D. Số electron của những nguyên tử lần lượt là 12,13,14
Câu 4: Hiđro có 3 đồng vị là 1H, 2H, 3H Oxi có 3 đồng vị là 16O, 17O, 18O. Trong tự nhiên, loại phân tử nước có phân tử khối lớn số 1 là:
A. 39u
B. 21u
C. 20u
D. 24u
Câu 5: Một nguyên tố X có 11 electron và 12 nơtron. Nguyên tố X có kí hiệu nguyên tử là:
A. 23X11
B. 11X23
C. 11X12
D. 12X11
Câu 6: Trong những dãy kí hiệu nguyên tử sau: (_7^14A,,,_9^19B,,,_26^56E,,,_27^56F,,,_8^17G,,,_10^20H,,,_11^23I,,,_10^22M)
Các kí hiệu nào cùng chỉ cùng 1 nguyên tố hóa học ?
A. A, B và G.
B. M và H.
C. H, I và M
D. E và F.
Câu 7: Phát biểu nào dưới đây không đúng?
A. Nguyên tử khối là khối lượng tương đối của nguyên tử
B. Đối với những nguyên tố có nhiều đồng vị, nguyên tử khối sẽ là giá trị trung bình của nguyên tử khối những đồng vị có tính đến tỉ lệ Phần Trăm số nguyên tử mỗi đồng vị.
C. Khối lượng của nguyên tử bằng tổng khối lượng của proton và electron.
D. Trong một số trong những trường hợp, hoàn toàn có thể coi nguyên tử khối bằng số khối.
Câu 8: Các electron của nguyên tử nguyên tố X được phân loại trên 3 lớp, lớp thứ 3 có 6 electron. Số cty điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6
B. 8
C. 14
D. 16
Câu 9: Nguyên tử của nguyên tố X có thông số kỹ thuật electron: 1s22s22p63s23p3. X là sắt kẽm kim loại hay phi kim?
A. Phi kim
B. Có thể vừa là sắt kẽm kim loại vừa là phi kim
C. Không là sắt kẽm kim loại cũng không là phi kim
D. Kim loại
Câu 10: Dãy gồm những ion X+, Y- và nguyên tử Z đều phải có thông số kỹ thuật electron 1s22s22p6 là:
A. Na+, F-, Ne.
B. Li+, F-, Ne.
C. Na+, Cl-, Ar.
D. K+, Cl-, Ar.
Câu 11: Cho 3 ion : Na+, Mg2+, F– . Phát biểu nào sau này sai ?
A. 3 ion trên có thông số kỹ thuật electron giống nhau.
B. 3 ion trên có thông số kỹ thuật electron của neon (Ne).
C. 3 ion trên có số electron bằng nhau.
D. 3 ion trên có số proton bằng nhau.
Câu 12: Nguyên tử nguyên tố M có phân loại electron ở phân lớp có nguồn tích điện cao nhất là 3d6. Tổng số electron của nguyên tử M là:
A. 24
B. 25
C. 26
D. 27
Câu 13: Cho biết cấu hình electron nguyên tử của những nguyên tố sau:
X là 1s2 2s2 2p2
Y là 1s2 2s2 2p6 3s1
Z là 1s2 2s2 2p6 3s2;
T là 1s2 2s2 2p6 3s2 3p1
Q. là 1s2 2s2 2p6 3s2 3p5
R là 1s2 2s2 2p6 3s2 3p6
Các nguyên tố kim loại là
A. Y, Z, T.
B. X, Y, T.
C. Z, T, Q..
D. T, Q., R.
Câu 14: Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng rất khác nhau về
A. số electron
B. số nơtron
C. số proton
D. số điện tích hạt nhân.
Câu 15: Nguyên tố Bo có 2 đồng vị bền là 11B (x1 %) và 10B (x2 %), nguyên tử khối trung bình của Bo là 10,8. Giá trị của x1 % là:
A. 80%
B. 20%
C. 10,8%
C. 89,2%
Câu 16: Một nguyên tử X có số khối là 80, X có tỉ lệ số hạt mang điện và số hạt không mang điện là 14/9. Số hạt không mang điện là
A. 80
B. 45
C. 35
D. 90
Câu 17: Nguyên tử kẽm có bán kính r = 1,35.10-1 nm và có khối lượng nguyên tử là 65u. Khối lượng riêng của kẽm là
A. 11,26 (g/cm^3 )
B. 10,48 ( g/cm^3)
C. 9,46 (g/cm^3 )
D. 12,28 (g/cm^3 )
Câu 18: Trong tự nhiên clo có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của Clo là 35,5. Tính thành phần % khối lượng của 37Cl trong KClO3 (cho K = 39; O=16)?
A. 7,24%
B. 7,55%
C. 25,00%
D. 28,98%
Câu 19: Nói về cấu trúc lớp vỏ electron của nguyên tử, phát biểu nào sau này sai?
A. Lớp thứ hai chứa tối đa 8 electron.
B. Phân lớp d chứa tối đa 5 electron.
C. Phân lớp p. chứa tối đa 6 electron.
D. Lớp thứ ba chứa tối đa 18 electron.
Câu 20: Các electron của nguyên tử nguyên tố X được phân loại trên 3 lớp, lớp thứ 3 có 6 electron. Số cty điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6
B. 8
C. 14
D. 16
Câu 21: Ở trạng thái cơ bản, thông số kỹ thuật electron của nguyên tử Na (Z = 11) là
A. 1s22s22p53s2
B. 1s22s22p63s1
C. 1s22s22p63s2.
D. 1s22s22p43s3
Câu 22: Cho biết nguyên tử X và Y lần lượt có số hiệu nguyên tử là 15 và 19. Nhận xét nào sau này là đúng?
A. X và Y đều là nguyên tử của nguyên tố sắt kẽm kim loại.
B. X và Y đều là nguyên tử của nguyên tố phi kim.
C. X và Y đều là nguyên tử của nguyên tố khí hiếm.
D. X là nguyên tử của nguyên tố phi kim còn Y là nguyên tử của nguyên tố sắt kẽm kim loại.
Câu 23: Trong ion M3- có tổng số hạt là 49, trong số đó số hạt mang điện nhiều hơn nữa số hạt không mang điện là 17. Cấu hình e của nguyên tố M là
A. 1s22s22p3
B. 1s22s22p63s23p3
C. 1s22s22p63s23p1
D. A, B, C sai
Câu 24: Cho 3,9g một sắt kẽm kim loại kiềm, tác dụng hết với dung dịch HCl dư thu được một,12 lit khí hiđro (ở đktc). Kim loại đó là
A. Mg
B. K
C. Na
D. Li
Câu 25: Cho 1,44 gam hỗn hợp gồm sắt kẽm kim loại M và oxit MO (oxit có hóa trị lớn số 1 của M) có số mol bằng nhau, tác dụng hết với H2SO4 đặc, đun nóng. Thể tích khí SO2 (đktc) thu được là 0,224 lít. Vị trí của M trong bảng tuần hoàn là
A. ô 30, chu kì 4, nhóm IIB.
B. ô 56, chu kì 4, nhóm VIIIB.
C. ô 12, chu kì 3, nhóm IIA.
D. ô 29, chu kì 4, nhóm IB,
Câu 26: Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,04% về khối lượng. Nguyên tố R là
A. As
B. N
C. S
D. P
Câu 27: Ion R+ có tổng số hạt cơ bản là 57 hạt, trong số đó số hạt mang điện nhiều hơn nữa số hạt không mang điện là 17 hạt. Vị trí của R trong bảng HTTH là:
A. ô 19, chu kỳ luân hồi 3, nhóm IA.
B. ô 11, chu kỳ luân hồi 3, nhóm VIIA.
C. ô 19, chu kỳ luân hồi 4, nhóm IA.
D. ô 19, chu kỳ luân hồi 2, nhóm VIIA.
Câu 28: Trong những hidroxit dưới đây, hidroxit nào có tính lưỡng tính?
A. NaOH
B. KOH
C. LiOH
D. Al(OH)3
Câu 29: Phát biểu nào sau này là sai?
A. Nguyên tử sắt kẽm kim loại thường có một, 2 hoặc 3 electron ở lớp ngoài cùng.
B. Các nhóm A gồm có những nguyên tố s và nguyên tố p..
C. Trong một chu kì, bán kính nguyên tử sắt kẽm kim loại nhỏ hơn bán kính nguyên tử phi kim.
D. Các sắt kẽm kim loại thường có ánh kim do những electron tự do phản xạ ánh sáng nhìn thấy được.
Câu 30: X và Y là hai nguyên tố thuộc cùng một chu kỳ luân hồi, hai nhóm A liên tục. Số proton của nguyên tử Y nhiều hơn nữa số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau này về X, Y là đúng?
A. Đơn chất X là chất khí ở Đk thường.
B. Độ âm điện của X to nhiều hơn độ âm điện của Y.
C. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron.
D. Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 e
Lời giải rõ ràng
Câu 1:
12X : 1s22s22p63s2
15Y : 1s22s22p63s23p3
Tính sắt kẽm kim loại : X > Y
Tính phi kim : X < Y
Đáp án A
Câu 2:
Câu không đúng là: Nguyên tử khối bằng số nơtron trong hạt nhân.
Đáp án D
Câu 3:
Sai là vì: Số n của những nguyên tử lần lượt là 12,13,14 chứ không phải số e.
Đáp án D
Câu 4:
Nước có công thức : H2O : phân tử khối của nước lớn số 1 khi phân tử khối của H và O là lớn số 1
=> 3H và 18O là lớn số 1 => M H2O = 3 . 2 + 18 = 24
Đáp án D
Câu 5:
ZXA : Z = số E và A = số P + số N = Số E + số N = 11 + 12 = 23
=> 23X11
Đáp án B
Câu 6:
Các kí hiệu cùng 1 nguyên tố hóa học là: (,_10^20H,,,_10^22M)
Đáp án B
Câu 7:
Phát biểu không đúng là: Khối lượng của nguyên tử bằng tổng khối lượng của proton và electron.
Đáp án C
Câu 8:
Cấu hình e nguyên tử X là: 1s22s22p63s23p4 => ZX = 16
Đáp án D
Câu 9:
X có 5e lớp ngoài cùng (3s23p3) → X là nguyên tố phi kim
Đáp án A
Câu 10:
X nhường 1e tạo thành ion X+ có thông số kỹ thuật 1s22s22p6
=> thông số kỹ thuật e của X là 1s22s22p63s1 => ZX = 11 (Na)
Y nhận 1e tạo thành ion Y- có thông số kỹ thuật 1s22s22p6
=> thông số kỹ thuật e của Y là 1s22s22p5 => ZY = 9 (F)
Z có thông số kỹ thuật 1s22s22p6 => ZZ = 10 (Ne)
Đáp án A
Câu 11:
D sai vì những ion là của những nguyên tố rất khác nhau nên số proton rất khác nhau
Đáp án D
Câu 12:
Nguyên tử nguyên tố M có phân loại electron ở phân lớp có nguồn tích điện cao nhất là 3d6.
Suy ra thông số kỹ thuật electron của nguyên tử nguyên tố M là 1s22s22p63s23p63d64s2.
Suy ra tổng số electron của nguyên tử nguyên tố M là 26.
Đáp án C
Câu 13:
Các nguyên tố kim loại là Y, Z, T (có một,2,3 e lớp ngoài cùng từ H, He, B)
Đáp án A
Câu 14:
Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng rất khác nhau về số nơtron.
Đáp án B
Câu 15:
%X1 + %X2= 100 %
=> %X1 = 80% ; %X2 = 20%
Đáp án A
Câu 16:
Số khối của X là 80: p. + n = 80 (1)
X có tỉ lệ số hạt mang điện (gồm hạt p. và hạt e) và số hạt không mang điện là 14/9: (frac2pn = frac149) (2)
Từ (1) và (2): p. = e = 35; n = 45.
Đáp án B
Câu 17:
RZn = 1,35.10-1 nm = 0,135.10-7 cm (1 nm = 10-9 m)
1u = 1,6605.10-24 gam
mZn = 65.1,6605.10-24 = 107,9.10-24 gam
Vnguyên tử Zn = $dfrac43.pi .R^3=dfrac43.pi .(0,135.10^-7)^3=10,3.10^-24,,cm^3$
Dnguyên tử Zn = (dfracmV = dfrac107,9.10^ – 2410,3.10^ – 24 = 10,48,,g/cm^3)
Đáp án B
Câu 18:
Giả sử % số nguyên tử của đồng vị 37Cl là x%, suy ra % số nguyên tử đồng vị 35Cl là (100-x)%
Nguyên tử khối trung bình của Clo được xem theo công thức:
(overline A_Cl = 37x + 35(100 – x) over 100 = 35,5)
Giải phương trình trên được x= 25%
Vậy % khối lượng của 37Cl trong KClO3 là:
%m37Cl= (0,25.37.100% over 39 + 35,5 + 16.3 = 7,55% )
Đáp án B
Câu 19:
Dựa vào quy tắc số electron tối đa trong phân lớp và lớp electron:
+ Lớp thứ n có tối đa 2n2 electron.
+ Phân lớp s có tối đa 2 electron, phân lớp p. có tối đa 6 electron, phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron.
– Xét A: Lớp thứ hai có chứa tối đa 2.22 = 8 electron → Phát biểu A đúng.
– Xét B: Phân lớp p. có tối đa 6 electron → Phát biểu C đúng.
– Xét C: Phân lớp d chứa tối đa 10 electron →Phát biểu B sai.
– Xét D: Lớp thứ ba có chứa tối đa 2.32 = 18 electron → Phát biểu D đúng.
Đáp án B
Câu 20:
Cấu hình e nguyên tử X là: 1s22s22p63s23p4 => ZX = 16
Đáp án D
Câu 21:
Na (Z = 11) có thông số kỹ thuật e là: 1s22s22p63s1
Đáp án B
Câu 22:
Cấu hình e của X: 1s22s22p63s23p3 => có 5 electron ở lớp ngoài cùng => phi kim
Cấu hình e của Y:1s22s22p63s23p64s1=> có một electron ở lớp ngoài cùng => Kim loại
Đáp án D
Câu 23:
Trong ion M3- có tổng số hạt là 49 => trong nguyên tử M có tổng số hạt = 49 – 3 = 46
=> p. + e + n = 2p + n = 46 (1)
Trong ion M3-, số hạt mang điện nhiều hơn nữa số hạt không mang điện là 17 => p. + e + 3 – n = 17
=> 2p – n = 14 (2)
Từ (1) và (2) => p. = e = 15 và n = 16
=> thông số kỹ thuật e của M là: 1s22s22p63s23p3
Đáp án B
Câu 24:
nH2 = 0,05 mol
nKL = 2nH2 = 0,1 mol
=> MKL = 3,9 : 0,1 = 39. Vậy sắt kẽm kim loại đó là K
Đáp án C
Câu 25:
M + 2H2SO4 → MSO4 + SO2 + 2H2O
0,01 ← 0,01
MO + H2SO4 → MSO4 + H2O
=> nMO = nM = 0,01 mol
=> mhỗn hợp = 0,01.(M + 16) + 0,01.M = 1,44 => M = 64
=> M là Cu (Z = 29)
Cấu hình e: 1s22s22p63s23p63d104s1 => Cu thuộc ô 29, chu kì 4, nhóm IB
Đáp án D
Câu 26:
Tổng hóa trị của nguyên tố trong hợp chất khí với hidro và trong oxit cao nhất có trị số bằng 8.
Công thức hợp chất khí là RH3 => Oxit cao nhất là R2O5
(% m_O = dfrac16.52R + 16.5.100% = 74,04% to R = 14)
Vậy R là N
Đáp án B
Câu 27:
R+ có p. + (e – 1) + n = 57 => R có 2p + n = 57 + 1 = 58
Trong R+ có : p. + (e – 1) = n + 17 => 2p – n = 18
=> p. = 19 và n = 20
=> R thuộc ô 19, chu kì 4, nhóm IA
Đáp án C
Câu 28:
Al(OH)3 là một hidroxit lưỡng tính.
Đáp án D
Câu 29:
A đúng theo SGK 10NC trang 32
B đúng theo SGK 10NC trang 59
C sai vì trong một chu kì: Zkim loại < Zphi kim → rkim loại > rphi kim
D đúng theo SGK 12CB trang 84
Đáp án C
Câu 30:
X và Y là hai nguyên tố thuộc cùng một chu kỳ luân hồi, hai nhóm A liên tục
TH1. pY – pX = 1 (X, Y thuộc chu kì 2, 3)
→(left{ begingatheredp_Y + p_X = 33 hfill \p_Y – p_X = 1 hfill \ endgathered right. to left{ begingatheredp_Y = 17 hfill \p_X = 16 hfill \ endgathered right. to left{ begingatheredY:,text[Ne]3s^23p.^5 hfill \X:,text[Ne]3s^23p.^4 hfill \ endgathered right. to left{ begingatheredY:,,Cl hfill \X:,,S hfill \ endgathered right.)
A sai vì đơn chất X là chất rắn ở Đk thường
B sai vì trong một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện tăng dần
(to ) Độ âm điện của Y to nhiều hơn độ âm điện của X
C sai vì lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 7 electron
TH2. pY – pX = 11 (X, Y thuộc chu kì 4, 5, 6, 7)
→(left{ begingatheredp_Y + p_X = 33 hfill \p_Y – p_X = 11 hfill \ endgathered right. to left{ begingatheredp_Y = 22 hfill \p_X = 11 hfill \ endgathered right. to left{ begingatheredY:,text[Ne]3s^23p.^63d^24s^2 hfill \X:,text[Ne]3s^1 hfill \ endgathered right.)
( to )Loại vì X, Y không thuộc cùng một chu kì
Đáp án D
Loigiaihay.com
Chia Sẻ Link Tải Trong một nguyên tử biểu thức nào sau này không đúng miễn phí
Bạn vừa tìm hiểu thêm Post Với Một số hướng dẫn một cách rõ ràng hơn về Review Trong một nguyên tử biểu thức nào sau này không đúng tiên tiến và phát triển nhất và Chia Sẻ Link Cập nhật Trong một nguyên tử biểu thức nào sau này không đúng miễn phí.

Giải đáp vướng mắc về Trong một nguyên tử biểu thức nào sau này không đúng
Nếu sau khi đọc nội dung bài viết Trong một nguyên tử biểu thức nào sau này không đúng vẫn chưa hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Admin lý giải và hướng dẫn lại nha
#Trong #một #nguyên #tử #biểu #thức #nào #sau #đây #không #đúng