Mẹo về Triethylamine là gì Chi Tiết
You đang tìm kiếm từ khóa Triethylamine là gì được Cập Nhật vào lúc : 2022-02-17 16:44:05 . Với phương châm chia sẻ Bí quyết Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi tìm hiểu thêm tài liệu vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Tác giả lý giải và hướng dẫn lại nha.
Triethylamine: cấu trúc, đặc tính, cách sử dụng và rủi ro không mong muốn
 Triethylamine: cấu trúc, đặc tính, cách sử dụng và rủi ro không mong muốn – Khoa HọC
Triethylamine: cấu trúc, đặc tính, cách sử dụng và rủi ro không mong muốn – Khoa HọC
NộI Dung:
- Cấu trúc của triethylamine
- Tính chất
- Ngoại hình
- Khối lượng phân tử
- Điểm sôi
- Độ nóng chảy
- Tỉ trọng
- Độ hòa tan
- Mật độ hơi
- Áp suất hơi
- Henry không đổi
- điểm đánh lửa
- Nhiệt độ tự bốc cháy
- Nhiệt dung
- Nhiệt do cháy
- Nhiệt hóa hơi
- Sức căng mặt phẳng
- Chỉ số khúc xạ
- Độ nhớt
- Hằng số cơ bản
- Cơ bản
- Các ứng dụng
- Polyme
- Sắc ký
- Sản phẩm thương mại
- Rủi ro
- Người trình làng
Các triethylamine là một hợp chất hữu cơ, đúng chuẩn hơn là một amin béo, có công thức hóa học là N (CH2CH3)3 hoặc NEt3. Giống như những amin lỏng khác, nó có mùi tương tự như mùi amoniac trộn lẫn với cá; hơi của nó khiến việc xử lý chất này trở nên tẻ nhạt và nguy hiểm mà không còn mũ trùm đầu hoặc quần áo thích hợp.
Nội dung chính
- Triethylamine: cấu trúc, đặc tính, cách sử dụng và rủi ro không mong muốn
- NộI Dung:
- Cấu trúc của triethylamine
- Tính chất
- Ngoại hình
- Khối lượng phân tử
- Điểm sôi
- Độ nóng chảy
- Tỉ trọng
- Độ hòa tan
- Mật độ hơi
- Áp suất hơi
- Henry không đổi
- điểm đánh lửa
- Nhiệt độ tự bốc cháy
- Nhiệt dung
- Nhiệt do cháy
- Nhiệt hóa hơi
- Sức căng mặt phẳng
- Chỉ số khúc xạ
- Độ nhớt
- Hằng số cơ bản
- Các ứng dụng
- Sản phẩm thương mại
- Người trình làng
- Morrison, R. T. và Boyd, R, N. (1987). Hóa học hữu cơ. Phiên bản thứ 5. Biên tập Addison-Wesley Interamericana.
- Carey F. (2008). Hóa học hữu cơ. (Tái bản lần thứ sáu). Đồi Mc Graw.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Hóa học hữu cơ. Các amin. (Tái bản lần thứ 10.). Wiley Plus.
- Wikipedia. (2022). Tritylamin. Khôi phục từ: en.wikipedia.org
- Merck. (2022). Tritylamin. Phục hồi từ: sigmaaldrich.com
- Trung tâm tin tức Công nghệ Sinh học Quốc gia. (2022). Tritylamin. Cơ sở tài liệu PubChem. CID = 8471. Được Phục hồi từ: pubchem.ncbi.nlm.nih.gov
- Mạng Dữ liệu Độc chất. (s.f.). Tritylamin. Đã Phục hồi từ: toxnet.nlm.nih.gov
- Sở Y tế New Jersey. (2010). Tritylamin. Đã Phục hồi từ: nj.gov
Ngoài những công thức tương ứng của chúng, hợp chất này thường được viết tắt là TEA; tuy nhiên, điều này hoàn toàn có thể dẫn đến nhầm lẫn với những amin khác, ví như trietanolamin, N (EtOH)3, hoặc tetraetylamoni, amin bậc bốn, NEt4+.

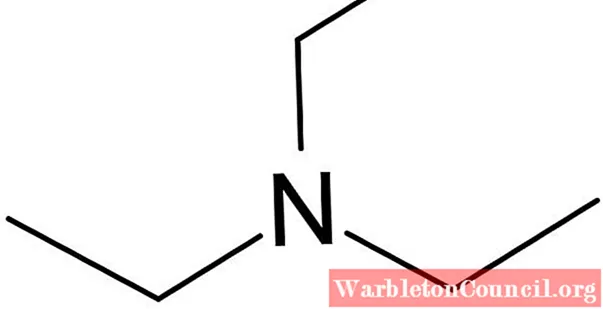
Từ bộ xương của nó (ảnh trên cùng), hoàn toàn có thể nói rằng rằng triethylamine khá giống với amoniac; trong lúc thứ hai có ba hydro, NH3, nhóm thứ nhất có ba nhóm etyl, N (CH2CH3)3. Quá trình tổng hợp của nó bắt nguồn từ việc xử lý amoniac lỏng với etanol, một quy trình alkyl hóa trình làng.
NEt3 hoàn toàn có thể tạo thành muối hút ẩm với HCl: trietylamin hydroclorid, NEt3· HCl. Ngoài ra, nó còn tham gia như một chất xúc tác giống hệt trong quy trình tổng hợp este và amit, làm cho nó trở thành dung môi thiết yếu trong những phòng thí nghiệm hữu cơ.
Ngoài ra, cùng với những thuốc thử khác, nó được cho phép oxy hóa rượu chính và rượu phụ tương ứng thành anđehit và xeton. Giống như amoniac, nó là một bazơ, và do đó nó hoàn toàn có thể tạo thành muối hữu cơ thông qua những phản ứng trung hòa.
Cấu trúc của triethylamine
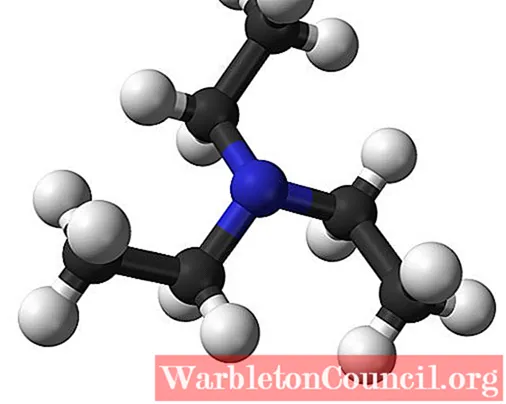
Hình ảnh trên đã cho toàn bộ chúng ta biết cấu trúc của triethylamine với quy quy mô cầu và thanh. Ở TT của phân tử là nguyên tử nitơ, được màn biểu diễn bằng một hình cầu hơi xanh; và link với nó, ba nhóm ethyl, in như những nhánh nhỏ của những quả cầu đen và trắng.
Mặc dù chúng không thể nhìn thấy bằng mắt thường, nhưng trên nguyên tử nitơ có một cặp electron không chia sẻ. Hai điện tử này và ba nhóm -CH2CH3 họ trải nghiệm lực đẩy điện tử; nhưng mặt khác, chúng góp thêm phần xác lập momen lưỡng cực của phân tử.
Tuy nhiên, mômen lưỡng cực như vậy nhỏ hơn mômen lưỡng cực, ví dụ, dietylamin, NHEt2; và tương tự như vậy, nó không hoàn toàn có thể hình thành link hydro.
Điều này là vì trong triethylamine không còn link N-H, và do đó, điểm trung tâm chảy và điểm sôi thấp hơn được quan sát thấy so với những amin khác tương tác Theo phong cách như vậy.
Mặc dù có một mômen lưỡng cực nhỏ nhưng không thể loại trừ lực phân tán Một trong những nhóm etyl của phân tử NEt.3 người hàng xóm. Cộng tác dụng này với nhau, hoàn toàn có thể lý giải được tại sao, tuy nhiên triethylamine dễ bay hơi, nhưng nó sôi ở khoảng chừng 89ºC, nhờ khối lượng phân tử tương đối lớn.
Tính chất
Ngoại hình
Chất lỏng không màu, có mùi amoniac rất khó chịu và mùi cá.
Khối lượng phân tử
101,193 g / mol.
Điểm sôi
89 ° C.
Độ nóng chảy
-115 ° C. Lưu ý lực link Một trong những phân tử link những phân tử trietylamin trong chất rắn của chúng yếu ra làm sao.
Tỉ trọng
0,7255 g / mL.
Độ hòa tan
Nó tương đối hòa tan trong nước, 5,5 g / 100g ở 20ºC. Dưới 18,7 ºC, theo Pubchem, nó thậm chí còn còn tồn tại thể trộn lẫn với nó.
Ngoài việc “hòa hợp” với nước, nó cũng hoàn toàn có thể hòa tan trong axeton, benzen, etanol, ete và parafin.
Mật độ hơi
3,49 trong quan hệ với không khí.
Áp suất hơi
57,07 mmHg ở 25 ° C.
Henry không đổi
66 μmol / Pa · Kg.
điểm đánh lửa
-15 ° C.
Nhiệt độ tự bốc cháy
312 ° C.
Nhiệt dung
216,43 kJ / mol.
Nhiệt do cháy
10,248 cal / g.
Nhiệt hóa hơi
34,84 kJ / mol.
Sức căng mặt phẳng
20,22 N / m ở 25 ° C.
Chỉ số khúc xạ
1.400 ở 20 ° C.
Độ nhớt
0,347 mPa · s ở 25 ° C.
Hằng số cơ bản
Tritylamin có pKb bằng 3,25.
Cơ bản
Tính bazơ của amin này hoàn toàn có thể được biểu thị bằng phương trình hóa học sau:
Mạng lưới3 + HÀ <=> NHEt3+ + A
Trong số đó HA là loài có tính axit yếu. Cặp NHEt3+ĐẾN nó tạo ra thứ trở thành muối amoni bậc ba.
Axit phối hợp NHEt3+ bền hơn amoni, NH4+, chính bới ba nhóm etyl hiến tặng một phần tỷ suất electron của chúng để làm giảm điện tích dương trên nguyên tử nitơ; do đó, trietylamin có tính bazơ hơn amoniac (nhưng ít bazơ hơn OH).
Các ứng dụng
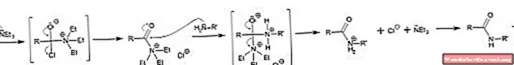
Tính cơ bản, trong trường hợp này, tính ưa nucleophin của trietylamin được sử dụng để xúc tác quy trình tổng hợp este và amit từ một cơ chất thông thường: acyl clorua, RCOCl (hình trên).
Ở đây cặp electron tự do từ nitơ tiến công nhóm cacbonyl, tạo thành chất trung gian; mà liên tục bị rượu hoặc amin tiến công để tạo thành este hoặc amit, tương ứng.
Trong số 1 tiên của hình ảnh, cơ chế tiếp theo là phản ứng tạo ra este được hiển thị, trong lúc hàng thứ hai tương ứng với amit. Lưu ý rằng trong cả hai phản ứng triethylamine hydrochloride, NEt3· HCl, từ đó chất xúc tác được tịch thu để khởi đầu một quy trình khác.
Polyme
Tính nucleophin của triethylamine cũng khá được sử dụng để thêm vào một trong những số trong những polyme nhất định, đóng rắn chúng và tạo ra khối lượng to nhiều hơn. Ví dụ, nó là một phần của quy trình tổng hợp nhựa polycarbonate, bọt polyurethane và nhựa epoxy.
Sắc ký
Tính đa tính và tính bay hơi từ xa của nó được cho phép những muối dẫn xuất của nó được sử dụng làm thuốc thử trong sắc ký trao đổi ion. Một hiệu suất cao ngầm khác của trietylamin là những muối amin bậc ba rất khác nhau hoàn toàn có thể thu được từ nó, ví như trietylamin bicacbonat, NHEt3HCO3 (hoặc TEAB).
Sản phẩm thương mại
Nó đã được sử dụng như một chất phụ gia trong công thức của thuốc lá điếu, thuốc dữ gìn và bảo vệ thực phẩm, chất tẩy rửa sàn, hương liệu, thuốc trừ sâu, chất tạo màu, v.v.
Rủi ro
Khói Triethylamine không riêng gì có rất khó chịu mà còn nguy hiểm, vì chúng hoàn toàn có thể gây kích ứng mũi, họng và phổi, dẫn đến phù phổi hoặc viêm phế quản. Tương tự như vậy, đặc hơn và nặng hơn không khí, chúng vẫn ở trên mặt đất, di tán đến những nguồn nhiệt hoàn toàn có thể tiếng nổ sau này.
Các thùng chứa chất lỏng này phải cách xa lửa vì chúng có rủi ro không mong muốn tiềm ẩn tiềm ẩn nổ sắp xẩy ra.
Ngoài ra, nên tránh tiếp xúc với những loài hoặc thuốc thử như: sắt kẽm kim loại kiềm, axit trichloroacetic, nitrat, axit nitric (vì nó sẽ tạo thành nitrosoamine, những hợp chất gây ung thư), axit mạnh, peroxit và pecmanganat.
Nó không được chạm vào nhôm, đồng, kẽm hoặc sắt kẽm kim loại tổng hợp của chúng, vì nó hoàn toàn có thể ăn mòn chúng.
Về tiếp xúc khung hình, nó hoàn toàn có thể gây dị ứng và phát ban da nếu tiếp xúc cấp tính. Ngoài phổi, nó hoàn toàn có thể ảnh hưởng đến gan và thận. Và liên quan đến tiếp xúc bằng mắt, nó gây kích ứng, thậm chí còn hoàn toàn có thể làm hỏng mắt nếu không được điều trị hoặc làm sạch kịp thời.
Người trình làng
Reply
9
0
Chia sẻ
Share Link Tải Triethylamine là gì miễn phí
Bạn vừa tìm hiểu thêm Post Với Một số hướng dẫn một cách rõ ràng hơn về Video Triethylamine là gì tiên tiến và phát triển nhất và Share Link Cập nhật Triethylamine là gì miễn phí.

Giải đáp vướng mắc về Triethylamine là gì
Nếu sau khi đọc nội dung bài viết Triethylamine là gì vẫn chưa hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Ad lý giải và hướng dẫn lại nha
#Triethylamine #là #gì